خلاصه (TL;DR) این خلاصه ای از کمان رقص شیمی است. خواندن این مطلب را به شدت توصیه می کنم. برای جزئیات بیشتر، پیوندها در عناوین هر بخش ارائه شده است.
–
تصویر از طریق آکادمی شیمی تصادف
قبل از اینکه به قوس جهان مولکول ها برویم، می خواهم خلاصه ای از آخرین قوس خود را ارائه دهم.
عناصر و پیوندهای شیمیایی

دیوانگی دنیای اتمی را می توان در یک کلمه خلاصه کرد: ثبات. دستهای از اتمها، گازهای نجیب، وجود دارند که بالاترین استانداردهای پایداری را نشان میدهند که یک اتم میتواند با توجه به عدد اتمی آن اتم یا تعداد پروتونهای آن به دست آورد. سمت راست جدول تناوبی که شامل هلیوم، نئون و آرگون است، نشان دهنده گازهای نجیب است. پایداری گازهای نجیب از پوسته الکترونی ظرفیت کامل آنها ناشی می شود، که باعث می شود آنها انرژی اتصالی نداشته باشند و غیر فعال باشند. اتم هایی مانند این ها پایدارتر هستند.
برای اتم هایی که گازهای نجیب نیستند، باید در پیوند اتمی شرکت کنند تا انرژی خود را کاهش دهند. پیوند اتمی را می توان با رقص بین دو شریک سازگار مقایسه کرد. در پیوند اتمی، اتمها از تأثیر الکترونهای خود برای نزدیکتر کردن اتمهای دیگر به یکدیگر استفاده میکنند تا نزدیکترین گاز نجیب خود را تقلید کنند.
به عنوان مثال، برای اینکه اتم هیدروژنی که دارای یک الکترون در پوسته خود است، مانند هلیوم، به گاز نجیب با دو الکترون در پوسته کامل خود تبدیل شود، باید با هیدروژن دیگری پیوند برقرار کند. وقتی فقط دو اتم به هم پیوند می خورند و یک مولکول را تشکیل می دهند، به آن a می گویند مولکول دو اتمی. هنگامی که این دو اتم یکسان باشند، مانند دو اتم هیدروژن پیوندی، a نامیده می شود یک مولکول دو اتمی هم هسته.
مولکول هیدروژن دو اتمی هم هسته رایج ترین و یکی از پایدارترین مولکول ها است مولکول های دو اتمی در کیهان
الکترون های هسته و الکترون های ظرفیت
اگر یک اتم هیدروژن که 1 پروتون در هسته خود دارد، یک الکترون در پوسته الکترونی خود دارد، پس چرا اصلاً پیوند برقرار می کند؟ به هر حال، شما فکر می کنید که بارهای منفی آن (الکترون ها) بارهای مثبت آن (پروتون) را خنثی می کنند.
واقعیت این است که لغو کامل تنها در صورتی امکان پذیر است که الکترون ها بار مثبت هسته را به طور کامل پوشش دهند. در عوض، الکترون های نزدیک به هسته بیشتر بار مثبت آن را می پوشانند. این الکترون ها نامیده می شوند الکترون های هسته و پتویی که روی هسته تشکیل می دهند نامیده می شود سپر الکترونیکی.
تعداد الکترون های هسته در هر اتم به دلیل سطح انرژی آنها است. الکترون های هسته کم انرژی ترین الکترون های یک اتم هستند. الکترون های کم انرژی نیز غیر فعال هستند زیرا برای آزاد کردن انرژی نیازی به پیوند ندارند. ما گروهی از اتمهای کم انرژی را میشناسیم که واکنشپذیر نیستند – گازهای نجیب. بنابراین میتوانیم تعداد الکترونهای هسته را بر اساس تعیین کنیم قبلی گاز نجیب. نگاهی ساده به جدول تناوبی قابل اعتماد در اینجا کمک می کند. به عنوان مثال، پتاسیم، اتم 19، دارای یک الکترون هسته دیکته شده توسط آرگون، اتم 18 است. به طور خاص، پتاسیم دارای 18 الکترون هسته است، همان تعداد الکترونی که آرگون در کل اتم خود دارد (پیکربندی الکترون آرگون: 1s22 ثانیه22 تن63s23t6 – در مجموع 18 الکترون).
با این حال، اتم پتاسیم دارای یک الکترون اضافی است که یک هسته نیست. انرژی این الکترون بسیار بالاتر از 18 الکترون دیگر است و همان چیزی است که ما a می نامیم الکترون ظرفیت. الکترونهای ظرفیتی توسط الکترونهای هسته دفع میشوند، که دارای همان بار منفی هستند، اما هنوز بهوسیله بار مثبتی که از سپر الکترونی عبور میکند به هسته متصل هستند.
این بار مثبت نشت شده به نام شناخته می شود شارژ موثر از اتم اگرچه بار موثر بسیار ضعیف تر از بار کل هسته است، اما همچنان به اندازه کافی قوی است که الکترون ها را جذب کند. این شارژ موثر (Zef) را می توان با کم کردن مقدار پروتون در هسته (Z) که باعث بار کامل هسته ای می شود، از مقدار الکترون های هسته در اتم (S) که این بار کامل را نمایش می دهد (فرمول: Z) نشان داد.ef = Z – S).
برای پتاسیم که دارای 18 الکترون هسته و 19 پروتون است، بار موثر آن +1 است، بنابراین فقط یک الکترون ظرفیت دارد. با این حال، این الکترون ظرفیتی هسته با بار مثبت را به دلیل دوری که دارد به طور کامل نمی پوشاند. این نه تنها به الکترون های ظرفیت اجازه می دهد در داخل اتم برای حس بار موثر، بلکه الکترون های ظرفیت خارج از اتم که آن را هم احساس کند. این اساس پیوند را تشکیل می دهد – جایی که هر الکترون ظرفیتی بارهای مؤثر سایر اتم های مجاور را حس می کند و جذب می شود.
معمولاً برای جلوگیری از نوشتن پیکربندیهای طولانی الکترون، از شکل هسته ظرفیت استفاده میکنیم که به آخرین مرجع آخرین گاز نجیب و الکترونهای ظرفیت در پوسته مربوطه اشاره دارد. به عنوان مثال، به جای پیکربندی کامل الکترونیکی پتاسیم – 1s22 ثانیه22 تن63s23t64s1 – به جای آن می توانیم بنویسیم [Ar]4s1.
الکترونگاتیوی اتم
آن اتمهایی که مقدار زیادی بار مؤثر دارند، از نظر میزان الکترونهایی که جذب میکنند، بر دیگران تسلط خواهند داشت. ما تمایل اتم به جذب الکترون را می نامیم الکترونگاتیوی.
وقتی اتمهایی با الکترونگاتیوی بالا پیوند میگیرند، الکترونهای ظرفیت را به خود نزدیکتر میکنند و بر نوع «رقص» اتمها در هنگام پیوند تأثیر میگذارند.
اتم هایی که دارای الکترونگاتیوی مشابه هستند دچار الف می شوند پیوند کووالانسی، جایی که آنها الکترون های ظرفیت را به طور مساوی با یکدیگر به اشتراک می گذارند. با این حال، برخی از اتم ها می توانند پیوندهای کووالانسی را بدون داشتن الکترونگاتیوی مشابه تشکیل دهند.
تصویر از طریق گروه شیمی، دانشگاه کالیفرنیا، لس آنجلس
در مورد پیوند بین اتم های هیدروژن و اکسیژن، الکترونگاتیوی اکسیژن ایجاد می کند. دوقطبی، که جداسازی بارهای مثبت و منفی در مولکول است (با نماد “δ” (دلتا) نشان داده می شود). اکسیژن که الکترونگاتیوتر است، در حین گرفتن الکترون های هیدروژن، دوقطبی منفی ایجاد می کند که به دوقطبی مثبت تبدیل می شوند.
این بارهای ناهموار توزیع شده در سراسر مولکول ایجاد می کنند پیوندهای کووالانسی قطبییک نوع منحصر به فرد از پیوند کووالانسی که در آن الکترون ها هنوز به اشتراک گذاشته می شوند، اما به طور نابرابر، بر خلاف پیوندهای کووالانسی معمولی.
اگر الکترونگاتیوی بین اتم ها عظیم باشد، حتی بیشتر از پیوندهای کووالانسی قطبی، پیوندهای یونی نتیجه ای که در آن یک اتم تمام الکترون های ظرفیت را به طور کامل به سمت خود جذب می کند. البته، این باعث می شود اتم الکترونگاتیو مانند یک بار منفی غول پیکر به نظر برسد و اتم بدون هیچ الکترونی مانند یک بار مثبت (به دلیل هسته با بار مثبت) رفتار می کند. اتم هایی که در پیوندهای یونی شرکت می کنند با این واقعیت ساده که بارهای منفی و مثبت به یکدیگر جذب می شوند، کنار هم نگه داشته می شوند.

کلاس اوراق قرضه دیگری وجود دارد که کاملاً شبیه بقیه نیست. اینها هستند اتصالات فلزی، ناشی از مجموعه ای از اتم هایی است که الکترونگاتیوی کمی دارند و می خواهند الکترون های خود را برای پیوند رها کنند. الکترونهای ظرفیت ضعیف به سمت هستههای اتمهای اطراف جذب میشوند. به طور مشابه، هستههایی که توسط این الکترونهای آزاد احاطه شدهاند، منجر به شبکهای صلب از اتمهای زیادی میشوند.
تصویر توسط Keisho Inoue از طریق شیمی IGCSE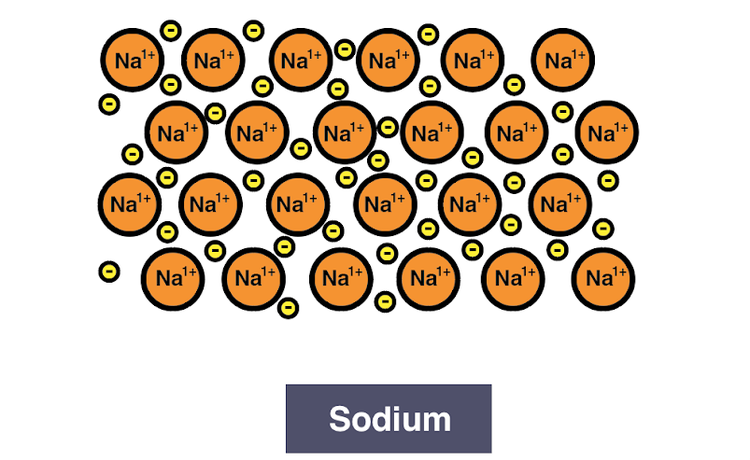
از آنجایی که این اتمها با الکترونهای ظرفیت خود پیوند سست دارند، انرژی کمتری دارند و پایدارتر هستند. با این حال، ابر الکترونها میتواند باعث افزایش ناگهانی انرژی شود، زیرا الکترونها به سرعت در این شبکه از اتمها حرکت میکنند و اتمهای پیوند فلزی را مجبور میکنند بین بیثباتی دورهای و پایداری چرخه کنند.
خواص فلزات، غیر فلزات و فلزات
تصویر از طریق علم خوب
پیوندهای مختلفی که ظاهر می شوند، اگرچه از نظر تعداد بسیار محدود هستند، می توانند با توجه به نوع اتم های درگیر در آن پیوندها منحصر به فرد باشند.
سه گروه عمده وجود دارد که همه انواع اتم ها را در بر می گیرد: فلزات، متالوئیدها و نافلزها.
فلزاتی که شامل فلزات قلیایی، فلزات قلیایی خاکی و فلزات رایج هستند عبارتند از:
-
رسانای عالی الکتریسیته و گرما
-
جامدات چکش خوار و انعطاف پذیر – به این معنی که می توان آنها را بدون شکستن یا از دست دادن استحکام به ورق یا سیم تبدیل کرد.
-
درخشان
غیر فلزات شامل غیر فلزات معمولی، هالوژن ها و گازهای نجیب عبارتند از:
-
هادی های وحشتناک برق و گرما
-
معمولاً مواد جامد شکننده – به این معنی که هنگام قالب گیری به راحتی می شکنند
-
خسته کننده اما رنگ های زیاد
متالوئیدها از خواص فلزات و غیرفلزات تقلید می کنند و بنابراین عبارتند از:
-
رسانای مناسب الکتریسیته و گرما.
-
به همین دلیل، آنها را نیمه هادی می نامند که به موادی گفته می شود که نه رسانای خوبی هستند و نه عایق خوبی (در مقابل یک هادی).
-
اینها همان “نیمه هادی”هایی هستند که در قطعات کامپیوتر استفاده می شوند!
-
-
-
جامدات شکننده
-
درخشان
با توجه به نوع اتم گاهی اوقات می توان تشخیص داد که چه نوع پیوندی تشکیل می شود. برای مثال، دو نافلز اغلب پیوندهای کووالانسی تشکیل می دهند. دو فلز پیوندهای فلزی تشکیل می دهند. یک فلز و یک نافلز، به خصوص اگر تفاوت زیادی در الکترونگاتیوی داشته باشند، پیوندهای یونی تشکیل می دهند. متالوئیدها که بین فلزات و غیر فلزات قرار دارند، بسته به اتمی که به آن پیوند می خورند، توانایی ایجاد هر نوع پیوندی را دارند.
هنگامی که یک پیوند منحصر به فرد رخ می دهد، نوع اتم ارتباط خود را از دست می دهد و جای خود را به ثبات می دهد – این هدف اصلی است. تنها استثناء این است که ماده a باشد ماده خالص، که در آن ماده ای است که فقط از یک نوع اتم یا مولکول تشکیل شده است. در مورد مواد خالص، خواص این ماده منعکس کننده خواص اتم ها است (و حتی ممکن است برخی افزایش یابد). به عنوان مثال، اگر دو اتم فلز به هم پیوند بخورند، مولکول حاصل دارای خواص فلزی مانند رسانایی بالای الکتریسیته و گرما خواهد بود.
بعدی: جهان مولکول ها
اتم ها برای کاهش انرژی فردی خود پیوند می خورند، اما آیا خود مولکول ها قوانینی دارند که از آنها پیروی می کنند؟ چگونه رشد کنیم تا مولکول ها را درک کنیم؟ این دو سوال به همراه چندین سوال دیگر در فصل های بعدی پاسخ داده خواهد شد. روی خط بمانید.
برای مطالب بیشتر تامل برانگیز، به ما بپیوندید لیست پستی!
برنامه های Flux برای سال 2020 را ببینید اینجا!




